सामग्री
टक्केवारी वस्तुमान रासायनिक कंपाऊंड बनविणार्या प्रत्येक घटकाची टक्केवारी निर्धारित करते. हे मूल्य शोधण्यासाठी आपल्यास ग्राउंड / मोल्समधील कंपाऊंड घटकांचे दाल मास किंवा द्रावण तयार करण्यासाठी वापरल्या जाणार्या ग्रॅमची संख्या आवश्यक असेल. टक्केवारी द्रव्यमान (किंवा सोल्यूशन) घटकाद्वारे घटक (किंवा विद्राव्य) च्या घटकांना विभाजित करते अशा मूलभूत सूत्रांचा वापर करून सोप्या पद्धतीने गणना केली जाऊ शकते.
पायर्या
पद्धत 1 पैकी 2: दिलेली वस्तुमान सह टक्केवारी वस्तुमान शोधत आहे
- कंपाऊंडच्या टक्केवारीसाठी समीकरण परिभाषित करा. कंपाऊंडचे मूळ सूत्र आहे: टक्केवारी द्रव्यमान = () x 100. टक्केवारी म्हणून मूल्ये व्यक्त करण्यासाठी शेवटी निकालास 100 ने गुणाकार करणे आवश्यक आहे.
- आपल्याला स्वारस्य असलेल्या रासायनिक संयुगेचा वस्तुमान म्हणजे समस्येमध्ये दिलेला वस्तुमान. हे मूल्य प्रदान न केल्यास, खालील पद्धतीचा संदर्भ घ्या आणि वस्तुमान दिले जात नाही तेव्हा टक्केवारी वस्तुमान कसे शोधायचे ते शिका.
- कंपाऊंड किंवा सोल्यूशन तयार करण्यासाठी वापरल्या जाणार्या सर्व घटकांची वस्तुमान जोडून कंपाऊंडची एकूण वस्तुमान मोजली जाते.
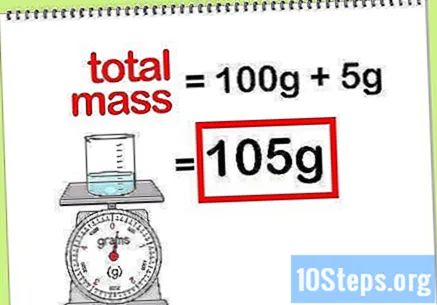
कंपाऊंडच्या एकूण वस्तुमानांची गणना करा. जेव्हा आपल्याला जोडलेल्या सर्व घटकांचे किंवा यौगिकांचे वस्तुमान मूल्य माहित असेल, तेव्हा आपल्याला कंपाऊंडच्या वस्तुमान किंवा अंतिम समाधानाची गणना करण्यासाठी फक्त त्यांना जोडणे आवश्यक आहे. टक्केवारी वस्तुमानाच्या गणनामध्ये हे मूल्य संप्रेरक असेल.- उदाहरणार्थ: 100 ग्रॅम पाण्यात विसर्जित 5 ग्रॅम सोडियम हायड्रॉक्साईडची टक्केवारी किती आहे?
- कंपाऊंडची एकूण वस्तुमान म्हणजे सोडियम पेरोक्साईड आणि पाण्याचे प्रमाण: 100 ग्रॅम + 5 ग्रॅम, एकूण 105 ग्रॅम.

प्रश्नातील रासायनिक वस्तुमान ओळखणे. जेव्हा आपल्याला शोधण्याची आवश्यकता असेल टक्केवारी वस्तुमान, समस्या आपल्याला सर्व घटकांच्या एकूण वस्तुमानाच्या टक्केवारी म्हणून विशिष्ट घटकांचा (प्रश्नातील घटक) वस्तुमान शोधू इच्छिते. प्रश्नातील घटकांची वस्तुस्थिती लक्षात घ्या. टक्केवारी वस्तुमानाच्या गणनामध्ये हे मूल्य एक अंकी असेल.- उदाहरणार्थ, घटकांचा वस्तुमान 5 ग्रॅम सोडियम हायड्रॉक्साईड आहे.
- टक्केवारी द्रव्याच्या सूत्रामध्ये बदल करा. प्रत्येक व्हेरिएबलची व्हॅल्यूज निर्धारित केल्यानंतर त्यास समीकरणात बदला.
- उदाहरणार्थ: टक्केवारी द्रव्यमान = () x 100 = () x 100.

टक्केवारी वस्तुमान मोजा. आता हे समीकरण तयार झाले आहे, तर टक्केवारी वस्तुमान मोजण्यासाठी हे सोडवा. कंपाऊंडच्या एकूण वस्तुमानाने घटकाचे घटक विभाजित करा आणि 100 ने गुणाकार करा. परिणाम रासायनिक घटकाचा टक्केवारी द्रव्यमान असेल.- उदाहरणार्थ: () x 100 = 0.04761 x 100 = 4.751%. अशाप्रकारे, 100 ग्रॅम पाण्यात विरघळलेल्या 5 ग्रॅम सोडियम हायड्रॉक्साईडची टक्केवारी प्रमाण 4.751% आहे.
2 पैकी 2 पद्धत: जनतेला टक्केवारी दिलेली नाही
- कंपाऊंडच्या टक्केवारीसाठी समीकरण परिभाषित करा. कंपाऊंडच्या टक्केवारी वस्तुमानाचे मूळ सूत्र आहे: टक्केवारी द्रव्यमान = () x 100. टक्केवारी म्हणून मूल्ये व्यक्त करण्यासाठी आपण शेवटी निकाल 100 ने गुणाकार करणे आवश्यक आहे.
- जेव्हा आपल्याला वस्तुमान मूल्ये ठाऊक नसतात तेव्हा आपण दाढीच्या वस्तुमानाचा वापर करून कंपाऊंडच्या घटकातील टक्केवारीचा घटक शोधू शकता.
- उदाहरणार्थ: पाण्याच्या रेणूमध्ये हायड्रोजनचे प्रमाण किती आहे?.
लिहा रासायनिक सूत्र. जर प्रत्येक कंपाऊंडसाठी रासायनिक सूत्र दिले गेले नाहीत तर आपण ते लिहून घ्यावे लागतील. अन्यथा चरण "प्रत्येक घटकाचे वस्तुमान शोधा" वर जा.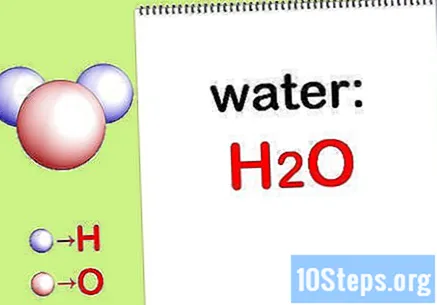
- उदाहरणार्थ, पाण्यासाठी रासायनिक सूत्र लिहा: एच2द.
कंपाऊंडमध्ये प्रत्येक घटकाचा वस्तुमान शोधा. नियतकालिक सारणीचा संदर्भ देऊन रासायनिक सूत्रांच्या प्रत्येक घटकाचे आण्विक वजन पहा. साधारणपणे, घटकांचा वस्तुमान रासायनिक घटक चिन्हाच्या खाली आढळू शकतो. कंपाऊंडच्या प्रत्येक घटकाची वस्तुमान लक्षात घ्या.
- उदाहरणार्थ, ऑक्सिजनचे आण्विक द्रव्यमान 15.9994 आहे आणि हायड्रोजनचे प्रमाण 1.0079 आहे.
मोलार प्रमाणानुसार लोकांना गुणाकार करा. रासायनिक कंपाऊंडमध्ये प्रत्येक घटकाचे किती मोल आहेत हे ओळखा. कंपाऊंडच्या सदस्यता घेतलेल्या संख्येद्वारे मोल्सची संख्या दिली जाते. प्रत्येक घटकाचे आण्विक द्रव्य दाबाचे प्रमाणानुसार गुणाकार करा.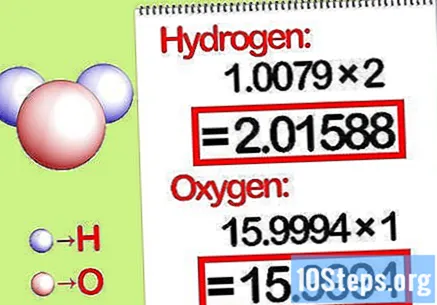
- उदाहरणार्थ, पाण्यात हायड्रोजन ते ऑक्सिजनचे दाणे प्रमाण 2: 1 आहे. म्हणून, हायड्रोजनचे आण्विक वजन दोन (1.00794 X 2 = 2.01588) ने गुणाकार करा आणि ऑक्सिजनचे आण्विक वजन जसे आहे तसे ठेवा (15.9994).
कंपाऊंडच्या एकूण वस्तुमानांची गणना करा. कंपाऊंडच्या सर्व घटकांची एकूण वस्तुमान जोडा. मोलार रेशोद्वारे मोजलेल्या वस्तुमानाचा वापर करून, कंपाऊंडच्या एकूण वस्तुमानांची गणना करणे शक्य आहे. ही संख्या टक्केवारीच्या सम समीकरणाचा भाजक असेल.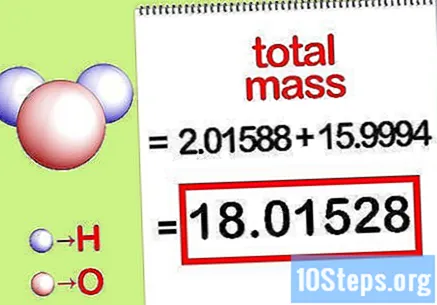
- उदाहरणार्थ, 15.9994 ग्रॅम / मोल (ऑक्सिजन अणूच्या एकाच मोलचा द्रव्य) सह 2.01588 ग्रॅम / मोल (हायड्रोजन अणूच्या दोन मोल्सचा समूह) जोडा आणि 18.01528 ग्रॅम / मोल मिळवा.
प्रश्नातील घटकांची संख्या ओळखा. जेव्हा आपल्याला शोधण्याची आवश्यकता असेल टक्केवारी वस्तुमान, समस्येची इच्छा आहे की आपण सर्व घटकांच्या एकूण वस्तुमानाच्या टक्केवारीच्या रुपात कंपाऊंडमध्ये विशिष्ट घटकाचा वस्तुमान शोधला पाहिजे. प्रश्नातील घटकाची वस्तुमान ओळखून ती लिहा. हे मोलार रेशोचा वापर करून मोजले जाणारे मूल्य मूल्य आहे. हे मूल्य टक्केवारी सम समीकरणाचे अंक आहे.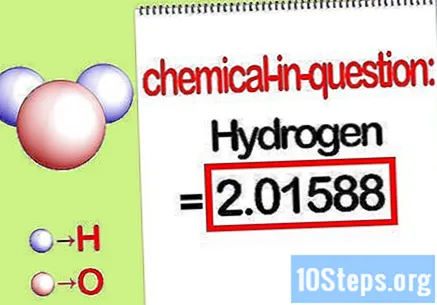
- उदाहरणार्थ, कंपाऊंडचा हायड्रोजन द्रव्यमान 2.01588 ग्रॅम / मोल (हायड्रोजन अणूच्या दोन मोलांचा समूह) आहे.
- टक्केवारी द्रव्याच्या सूत्रामध्ये बदल करा. प्रत्येक चल करीता मूल्ये ठरवल्यानंतर, त्यांना पहिल्या चरणात परिभाषित केलेल्या समीकरणात बदला: टक्केवारी द्रव्यमान = () x 100.
- उदाहरणार्थ: टक्केवारी द्रव्यमान = () x 100 = () x 100.
टक्केवारी वस्तुमान मोजा. आता हे समीकरण तयार झाले आहे, तर टक्केवारी वस्तुमान मोजण्यासाठी हे सोडवा. कंपाऊंडच्या एकूण वस्तुमानाने घटकाचे घटक विभाजित करा आणि 100 ने गुणाकार करा. परिणाम रासायनिक घटकाचा टक्केवारी द्रव्यमान असेल.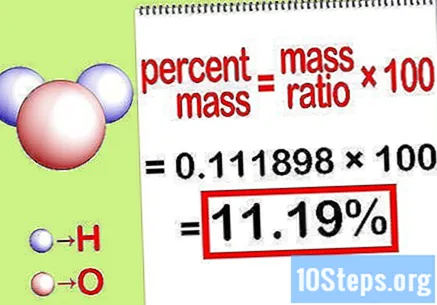
- उदाहरणार्थ, टक्केवारी द्रव्यमान = () x 100 = 0.111189 x 100 = 11.18%. अशाप्रकारे, पाण्याच्या रेणूमधील हायड्रोजन अणूंचे प्रमाण टक्केवारी 11.18% आहे.